Спектры атомов наблюдаемые в спектроскоп при испускании и поглощении представляет собой ряд узких цветных полос, сконцентрированных вблизи определенных значений частот или длин волн. Они не похожи на привычные нам спектры радуги или лампочки накаливания, в которых цвета постепенно переходят из одного в другой.
Спектр — распределение значений определенной физической величины как частоты (длины волны), энергии, массы и т.п.
Вообще говоря, спектры атомов различны, поскольку каждому присущи свои энергетические уровни. Установив однажды распределение значений физической величины какого-либо атома, мы можем в дальнейшем использовать для опознания элемента, находящегося в других условиях. Наука физическая химия изучает вещества на молекулярном и атомном уровне.
Значение измерений
Например, измеряя частоты светового излучения, приходящего к нам от далеких галактик, и обнаруживая, что некоторые из них совпадают с частотами излучения в спектре атома водорода, мы можем сделать вывод о наличии атомов водорода в этих галактиках.
Иногда в распределении значений физической величины излучения космических объектов обнаруживаются частоты, которым исследователи не находят соответствия в известных им атомах или молекулах. Именно так был открыт в атмосфере Солнца неизвестный прежде элемент — гелий.
В других случаях неотождествленная частота относится к спектру излучения не атома, а иона. Энергетические уровни иона отличаются от энергетических уровней соответствующего ему нейтральной наименьшей частице химического элемента, поэтому спектр излучения иона содержит другой набор частот.
Для изучения спектров атомов, содержащее вещество, обычно нагревают. При этом частицы химического элемента начинают двигаться быстрее, и число их столкновений увеличивается. В результате, количество электронов, которые находятся в возбужденном состоянии, а стало быть, и количество излучаемых фотонов, возрастают. Движение наименьших частиц химического элемента, в какой-то мере, сказывается и на энергиях излучаемых ими фотонов (в частности, вследствие эффекта Доплера).
Изучение излучений
Спектры атомов лучше всего изучать в газах, особенно разреженных. Дело в том, что при большой плотности частиц, как, например, в твердом теле, они могут влиять друг на друга, поэтому свет, испускаемый твердым телом, имеет мало общего с тем излучением, которое создавали бы составляющие его частицы химического элемента по отдельности. Разумеется, излучение твердого тела также представляет большой интерес, но это явление совершенно иного рода и лишь косвенным образом связано со свойствами отдельных элементов.
В газе, где частицы находятся далеко друг от друга, каждый атом излучает независимо от других, и наблюдаемое распределение значений физической величины газа практически соответствует спектру отдельного атома.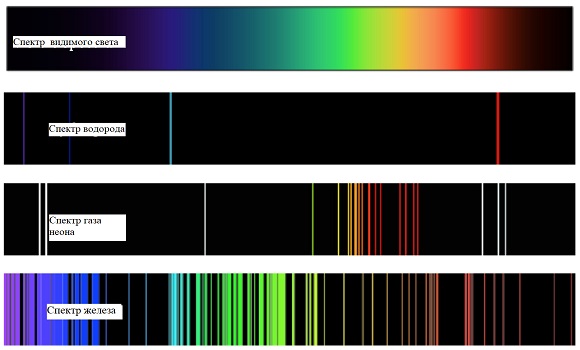
Измеряя энергии различных фотонов, излучаемых элементарными элементами, мы можем определить разности энергий электронных состояний в атоме. Чтобы знать не только разности энергий, но и сами энергии состояний, необходимо измерить энергию, хотя бы одного из них, каким-то иным методом.
Энергии электронов, получаемые с его помощью по известным энергиям фотонов, можно сравнить с их теоретическими значениями, вычисленными из уравнения Шредингера. Уравнение Шрёдингера описывает вероятность нахождения частицы в определенной точке пространства. В целом, измеренные и вычисленные значения хорошо согласуются.
Таким образом, спектры атомов позволяют идентифицировать присутствующие в образце элементы.
Существует целая наука спектроскопия разработавшая целые методы количественного анализа в различных областях, таких, как химия, физика, биохимия, материаловедение, химическая инженерия, медицинское применение. Кроме того спектральный анализ атомов широко применяется в науках изучающих космос.



