За последние десятилетия исследования показали, что прогрессирующие изменения в эпигенетической информации сопровождают процесс старения делящихся и неделящихся клеток.
Эпигенетическая информация — изменения активности генов. Гены состоят из клеток.
Функциональные исследования простых организмов и сложных как человек показывают, что эпигенетические изменения оказывают огромное влияние на процесс старения. Эти эпигенетические изменения происходят на различных уровнях, в том числе снижение массового уровня основных гистонов.
Гистоны – белки, связывающие непосредственно ДНК.
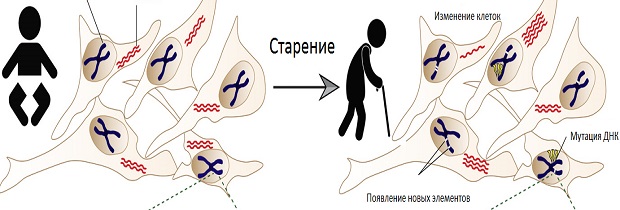
Биологическая предрасположенность старения
Старение организма — сложный многофакторный биологический процесс, общий для всех живых организмов. Он проявляется постепенным снижением нормальных физиологических функций в зависимости от времени. Биологическое старение организма имеет важное значение для здоровья человека, потому что с возрастом увеличивается восприимчивость ко многим болезням, включая рак, метаболические расстройства, такие как диабет, сердечно-сосудистые нарушения и нейродегенеративные заболевания. С другой стороны, старение клеток, также называемое репликативная деградация, является специализированным процессом и рассматривается как потенциальный эндогенный противоопухолевый механизм при котором происходит необратимый рост потенциальных онкогенных стимулов. Клеточное старение носит много общего с процессом старения, но и показывает отличительные черты. Хотя причины старения недостаточно изучены, продолжаются усилия, чтобы очертить пути долголетия.
В последние годы большие успехи достигнуты в ходе многочисленных исследований, что эффективно проявляется на клеточных и молекулярных признаках старения. Среди этих признаков эпигенетические изменения являются одними из важнейшим механизмов ухудшения функции клеток, наблюдаемые при старении и возраст-зависимых заболеваний.
Эпигенетика изучает закономерности изменения генов
По определению эпигенетика представляет обратимый наследственный механизм который происходит без какого-либо изменения базовой последовательности ДНК, а также происходит репарация ДНК.
Репарация ДНК — способность исправлять повреждения
Хотя хромосомы в геноме несут в себе генетическую информацию, эпигеном, ответственным за функциональное использование и стабильность является генотип с фенотипом – общими характеристиками. Эти эпигенетические изменения могут быть спонтанными или под влиянием внешних или внутренних воздействий. Эпигенетика потенциально служит недостающим звеном, чтобы объяснить, почему картина деградации отличается от двух генетически идентичных особей, таких, как однояйцовые близнецы, или же, в животном мире, между животными с одинаковой генетической структурой, например, матки и рабочих пчел.
Исследования долголетия населения показали, что генетические факторы могут объяснить от 20 до 30% различий наблюдаемых в продолжительности жизни близнецов, большинство остального разброса возникло через эпигенетическое изменение в течение своей жизни — различное влияние окружающей среды, включая питание.
Например, различные дифференциальные изменения хранимой эпигенетической информации создает поразительный контраст во внешности, репродуктивном поведении и продолжительности жизни рабочих пчел и матки, несмотря на идентичное содержание ДНК.
Таким образом, эпигенетика открывает большие перспективы для выбора лечебных мероприятий при генетических изменениях, которые в настоящее время технически необратимы в организме человека. Соответственно, определение и понимание эпигенетики и эпигенетических изменений, которые происходят во время старения, является основной областью исследования, которое может проложить путь к разработке новых терапевтических подходов к задержке старения и возрастных заболеваний.
Эпигенетические изменения при старении
Существуют различные типы эпигенетической информации, закодированной в наш эпигеном, включая, но не ограничиваясь наличием или отсутствием гистонов на какой-либо конкретной последовательности ДНК.
Эти различные типы эпигенетической информации составляют наш эпигеном и являются важными определяющими факторами функционирования и судьбу всех клеток и тканей организма как одноклеточных, так и многоклеточных организмов. Несомненно, каждый из этих различных видов эпигенетической информации является функционально значимым для процесса старения.
Все больше свидетельств в последние годы также явно указывают на структуру хроматина, который несет много эпигенетической информации, как основного игрока в процессе старения. Основная единица структуры хроматина является нуклеос, который состоит из 147 пар оснований ДНК обернутых вокруг гистонов. Упаковка геномной ДНК в высокоорганизованную структуру хроматина регулирует все геномные процессов в ядре, в том числе репликацию ДНК, транскрипцию, рекомбинацию и репарацию ДНК, контролируя доступ к ДНК.
Хроматин – вещество хромосом
Исследования на людях и различных моделей деградации свидетельствуют о прогрессирующей потери конфигурации при старении хромосомной архитектуры, целостность генома и экспрессия генов. Исследования подтвердили, что все эти эффекты в основном сохраняется на всем пути от одноклеточных организмов, таких как дрожжи, до сложных многоклеточных как человек. Эти сохраняющиеся механизмы помогают получить более четкое представление о процессе старения. Эпигенетические изменения в значительной степени влияют на процесс старения для последующих достижений в области эпигенетики и выявления возможных перспективных направлений.
Сокращение гистона при старении
Репликативное нарушение сопровождается потерей примерно половина основных гистоновых белков.
Гистоны – белки ДНК
Резкое снижение основных гистоновых белков обусловлено снижением синтеза белков гистонов. У человека, снижение синтеза новых гистонов во время деградации является следствием роста укороченной длины теломера, которые активируются в ответ на повреждение ДНК, потенциально объясняя механизм укорочения теломер ограничением числа делений клеток. Следовательно, потери основных гистонов может быть более обобщенное явление, наблюдаемое с возрастом у многих организмов.
Процесс старения, несомненно, является сложным. В организме жизни, старение клетки претерпевает множество изменений и происходит накопление повреждений макромолекул. Фенотип старения проявляется путем суммирования изменений различных сигналов.
Генетические и экологические изменения однозначно важно расшифровать для действия конкретного фактора на процесс долголетия. Становится очевидным механистически, что многие из тех факторов, которые влияют на продолжительность жизни, действуют главным образом путем модификации эпигенома. Несомненно, эпигенетическое влияние на процессы старения должны быть включены в нашем нынешнем понимании старения.
Старение клетки
Молодые здоровые клетки поддерживают эпигенетическое состояние, что способствует образованию компактной структуры гистона и регуляции основных биологических процессов. Однако старение клетки испытывают изменения во всех аспектах. Обратимый характер эпигенетических механизмов позволяет восстановить или обратить вспять некоторые из этих фенотипов для достижения более молодой клетки. В то время как некоторые молекулярные изменения при старении могут быть классифицированы как причина старения, другие изменения просто сопровождают процесс старения. Однако, характеризуя причины и последствия деградации, нужно внимательно проанализировать экспериментальные результаты, поскольку большинство соответствующих путей взаимосвязаны.
Постоянное сочетание функционального анализа и молекулярного анализа в разных возрастных группах, у разных организмов и разных типах тканей даст всю необходимую информацию чтобы постичь этот эволюционно законсервированный основной процесс с целью разработки терапевтических мероприятий, чтобы противодействовать возраст-индуцированным осложнениям. Центральное понятие складывается для разработки эпигенетических препаратов или даже эпигенетического питания.
Таким образом, основные проблемы, которые будут доминировать на поле в ближайшем будущем будет достижение иерархического понимания того, как эпигенетика влияет на процесс старения и понимание долгосрочных эффектов лечебных вмешательств на эпигеном в стареющем человеке, учитывая взаимосвязанность эпигенетических механизмов.
Несколько важные выводы вытекают из этих исследований: генетическая предрасположенность старения 20-30 %, а остальное в нашей жизни во многом определяется питанием и другими воздействиями внешней среды.
Результаты обеспечивают лучшее понимание механизмов вовлеченных в процесс старения. Учитывая обратимый характер эпигенетической информации, исследования подчеркивают огромные возможности для терапевтического вмешательства при старении и возраст-ассоциированных заболеваний, включая рак.
Старение иммунной системы
Старение связано со снижением функции иммунной системы (иммуносенесценция), что приводит к повышенной восприимчивости как к бактериальным, так и к вирусным инфекциям, злокачественным новообразованиям, аутоиммунным расстройствам и снижению реакции на вакцинацию.
В основном это объясняется изменениями в адаптивном иммунитете, поскольку Т-лимфоциты демонстрируют сниженную иммунную реакцию на антигены и цитотоксическую активность, измененную активность белков секреции и накопление подмножества лимфоцитов памяти, вызванные физиологической инволюцией тимуса. Тимус расположен в верхней части грудной клетки, сразу за грудиной. Кроме того, клетки демонстрируют сниженную выработку высокоаффинных антител и общую неспособность к формированию долговременных реакций памяти. Более того, недавние исследования показали, как старение человека влияет на внутренние компоненты иммунной системы, такие как макрофаги и NK-клетки (естественные киллеры). Поскольку дендритные (вспомогательные) клетки являются наиболее важными антигенпредставляющими клетками, играющими ключевую роль. Функция этих клеток в связи между врожденным и адаптивным иммунитетом, что влияние их поведения на протяжении всей жизни имеет значение.
Эти клетки повсеместно распределены во всех периферических тканях, выполняя роль сторожевых, специализирующихся на поглощении и обработке антигена. После захвата они мигрируют в дренирующие лимфатические узлы, где представляют антигены Т-клеткам, вызывая ответ адаптивной иммунной системы. Во время этой миграции они приобретают несколько фенотипических и функциональных особенностей необходимых для правильной презентации антигена и выделения цитокинов, привлекающих и стимулирующих Т-лимфоциты, а также В-клетки и NK-клетки.
Дендритные (вспомогательные) клетки также являются важнейшими медиаторами иммунной толерантности и анергии, в зависимости от типа антигена, с которым они борются, и от среды, в которой они созревают.
Таким образом, процесс старения исходит от клетки организма.




Но и наоборот само критическое укорачивание запаса теломер на концах приводит к быстрому накоплению количества дефектов в ДНК в процессе деления и может наоборот провоцировать развитие рака.