Почти вся теоретическая химия, связанная с атомными и молекулярными реакциями, является квантовой физикой, которая изучает энергетические изменения, связанные с электронами. Важным понятием, связанным с электронами, является определение что такое ионизация.
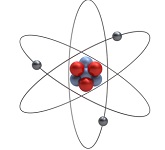 Атом состоит из центрального ядра, содержащего положительно заряженные протоны и нейтроны, которое окружены электронами, вращающимися вокруг него на орбиталях с определенными энергетическими уровнями. Электроны связаны с атомным ядром из-за электромагнитной силы притяжения.
Атом состоит из центрального ядра, содержащего положительно заряженные протоны и нейтроны, которое окружены электронами, вращающимися вокруг него на орбиталях с определенными энергетическими уровнями. Электроны связаны с атомным ядром из-за электромагнитной силы притяжения.
Чтобы освободиться от силы притяжения атомного ядра, электрону требуется энергия, которая может поступать из внешних источников. Если этой энергии окажется достаточно образуются ионы.
Ионы-это атомы, которые получили или потеряли электроны.
Процесс расщепления молекул вещества на положительные и отрицательные ионы при растворении вещества называется ионизацией.
Ионизация является эндотермической, то есть атом или молекула увеличивает свою внутреннюю энергию (берет из внешнего источника). Для каждого атома химического элемента, уровни этой энергии для каждой атомной орбитали отличаются.
Что необходимо для процесса расщепления
Для процесса расщепления молекул вещества с образованием ионов необходима энергия ионизации, ионизационный потенциал. Определяется как общее количество энергии, необходимой для освобождения электрона, который вращается во внешней оболочке любого атома.
Кроме того, химики также определяют его как полную энергию, необходимую для освобождения одного моля электронов от одного моля конкретного атома.
В физике предпочитают использовать электронвольты (eV, эВ) на атом, как единицу для потенциала ионизации, в то время как в химии измеряется в терминах кДж/моль (килоджоулей на моль). Например, энергия ионизации водорода 13,5984 эВ (1310 кДж/моль).
Чем ниже энергия, тем выше тенденция атома становиться восстановителем и более реактивным он является. С другой стороны, чем выше энергия ионизации, тем выше тенденция становиться окислителем и менее реактивным.
Энергия, необходимая для выделения одного электрона из внешней энергетической оболочки атома, известна как первый потенциал ионизации, в то время как энергия, необходимая для освобождения от второго, известна как второй потенциал ионизации. Второй потенциал ионизации всегда выше первого. Это происходит потому, что, чем больше убирается электронов из его внешних оболочек, тем сильнее атом удерживает остальные, которые остались.
Сейчас мы подробно поговорим что такое ионизация в процессе.
Процесс образования ионов на примере
Чтобы понять процесс ионизации, рассмотрим структуру хлорида натрия. Хлорид натрия — это поваренная соль которую мы используем в нашей повседневной жизни. Атомные номера Na и Cl равны 11 и 17 соответственно. Это означает, что атом натрия имеет 11 и атом хлора имеет 17 электронов на своих орбитах.
Атом Na имеет только один электрон на своей внешней орбите. В то время как хлор содержит семь на своей внешней орбите. Но мы знаем, что для стабильности атомы обычно требуют восемь электронов на своей внешней орбите. Таким образом, оба указанных атома химически активны. Когда эти атомы собраны вместе, атом Na теряет свои самые внешние электроны, становится положительно заряженным, а атом Cl получает один электрон и становится отрицательно заряженным. Так как атомы получают восемь электронов в их внешней орбиты путем их обмена. Между Na и Cl действует электростатическая сила между и они совместно сделали одну молекулу NaCl.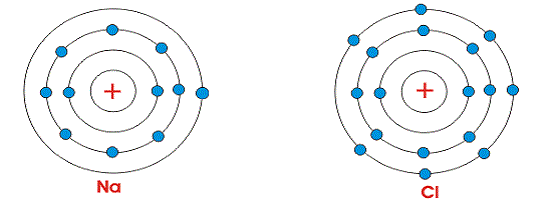
Как отмечается, ионные связи возникают, когда металл связывается с неметаллом, и эти связи чрезвычайно прочны.
Таким образом, соль образуется ионной связью между металлическим натрием (катион +1) и неметаллическим хлором (анион -1). При этом Na соединяется с Cl с образованием NaCl или поваренной соли. Прочность скрепления в соли отражена своей высокой точкой плавления 800°C.
Ионные соединения и твердые тела
Не только соль сформирована ионным скреплением. Соль также пример ионного твердого тела или кристаллического твердого тела которое содержит ионы.
Кристаллический солидис: тип твердого тела в котором составные части аранжированы в простой, определенной геометрической картине которая повторена во всех направлениях.
Существует три типа кристаллического твердого вещества: молекулярное твердое (например, сахароза или столовый сахар), в котором молекулы имеют нейтральный электрический заряд; атомная твердые (алмаз, например, из чистого углерода); и ионные твердые.
Соль не образуется из обычных молекул, как вода или углекислый газ. Внутреннюю структуру соли можно представить в виде повторяющейся серии хлоридных анионов и катионов натрия, плотно упакованных друг с другом, как апельсины в ящике.
Эта плотная упаковка положительных и отрицательных зарядов помогает сформировать плотное скрепление, и поэтому соль необходимо нагреть до высокой температурой прежде чем она расплавится. Твердая соль не проводит электричество, но расплавленная, она становится весьма хорошим проводником. Когда она твердая, ионы плотно упакованы, и таким образом не способствуют движению электрических зарядов; но когда структура нарушена путем плавления или растворения в чем либо движение ионов возможно.
Энергия для процесса
Вода не является хорошим проводником, хотя она, безусловно, позволит протекать через нее электрическому току, поэтому опасно эксплуатировать электроприбор вблизи воды.
Соль при расплавлении становится хорошим проводником, но этого можно добиться и растворением ее в воде.
На примере поваренной соли видно что такое ионизация. Однако это один из видов ионизации, который может быть определен как процесс, в котором один или несколько электронов удаляются из атома или молекулы, чтобы создать ион, или процесс, в котором ионное твердое вещество, такое как соль, диссоциирует на его компонентные ионы при растворении в растворе.
Количество энергии, необходимое для достижения ионизации, называется энергией ионизации или потенциалом ионизации.
Когда атом находится на своем нормальном энергетическом уровне, говорят, что он находится в основном состоянии. В этот момент электроны занимают свои нормальные орбитальные структуры. Между электроном и положительно заряженным ядром, в котором находятся протоны, всегда существует высокая степень притяжения. Энергия, необходимая для перехода электрона на более высокую орбиталь увеличивает общую энергию атома, который находится в возбужденном состоянии.
Возбужденное состояние атома — это просто шаг на пути к его ионизации путем удаления электрона. «Шаг» является подходящей метафорой, потому что электроны не просто дрейфуют вдоль континуума от одного энергетического уровня к другому, как человек поднимается по лестнице. Они делают дискретные шаги, как человек взбирается по лестнице или трапу. Это один из ключевых принципов квантовой механики, передовой области физики, которая также имеет многочисленные приложения к химии. Подобно тому, как говорится о внезапном изменении как о «квантовом скачке», электроны совершают квантовые скачки с одного энергетического уровня на другой.
Из-за высокого притяжения между электроном и ядром первый удаляемый электрон находится на самой внешней орбите. Это количество энергии называется первой энергией ионизации. Удалить второй электрон будет значительно сложнее, так как теперь атом является катионом, а положительный заряд протонов в ядре больше отрицательного заряда электронов. Следовательно, энергия, необходимая для удаления второго электрона намного выше, чем первая.
Образование ионов элементов и соединений
Существуют уровни энергии ионизации для элементов, хотя следует отметить, что водород, поскольку имеет только один электрон, имеет только первую энергию ионизации. Как правило, показатели увеличиваются слева направо вдоль периода или строки периодической таблицы и уменьшаются сверху вниз вдоль столбца или группы.
Причина, по которой энергия ионизации увеличивается вдоль периода, заключается в том, что неметаллы в правой части таблицы имеют более высокую энергию, чем металлам, которые находятся на левой стороне. Величина уменьшается вдоль группы, потому что элементы ниже в таблице Менделеева имеют более высокие атомные номера, что означает больше протонов и, следовательно, больше электронов. Поэтому им легче отказаться от одного из своих электронов, чем от элемента с более низким атомным номером — так же, как миллионеру было бы легче потерять тысячу рублей, чем это было бы для человека, зарабатывающего минимальную заработную плату.
Для молекул в соединениях энергия ионизации обычно связана с элементами, атомы которых составляют молекулу. Подобно тому, как элементы с меньшим количеством электронов, как правило, менее склонны отказаться от одного, так и молекулы с несколькими атомами. Таким образом, энергия ионизации диоксида углерода (СО2), содержащего всего три атома, относительно высока. И наоборот, в больших молекулах, как с большими атомами, есть больше электронов, чтобы отказаться, и поэтому легче отделить один из них от молекул.
Применение процесса
Ряд методов используется для получения ионов для масс-спектрометрии или других применений. Наиболее распространенным из этих методов является электронный удар, производимый бомбардировкой образца газа потоком быстро движущихся электронов. Хотя легче, чем некоторые другие методы, этот не особенно эффективен, потому что необходимо больше энергии для удаления электрона. Электронная пушка, обычно нагретая вольфрамовая проволока, производит огромное количество электронов, которые затем выстреливаются в газ. Поскольку электроны настолько малы, это скорее похоже на использование скорострельного пулемета для уничтожения комаров: почти неизбежно, что некоторые из комаров будут поражены, но много раундов придется стрелять в воздух, не поражая ни одного насекомого.
Другим процессом ионизации является ионизация полем, при которой она производится путем воздействия на молекулу очень интенсивного электрического поля. Ионизация поля происходит в ежедневной жизни, когда статическое электричество образует малую искру. Искра фактически поток электронов.
В прикладных лабораториях профессионально известно что такое ионизация и используются точные приборы. Этот процесс гораздо более эффективен, чем электронным ударом и требуется гораздо меньше энергии по отношению к энергии, необходимой для удаления электронов. Технологические достижения медицины широко применяют этот процесс.
Химическая ионизация использует метод подобный ионизации удара электрона, за исключением того, что вместо электронов, луч используется для того чтобы бомбардировать и ионизировать образец. Ионы используемые в этой бомбардировке типично малые молекулы, как в метане, пропане или аммиаке. Тем не менее, молекулярный ион гораздо больше чем электрон, и эти столкновения высокореактивны.
Многие масс-спектрометры используют источник, способный как к электронному удару, так и к химической ионизации.
Ионизация может обеспечиваться электромагнитным излучением, длина волны которого короче длины волн видимого света, т. е. ультрафиолетовым светом, рентгеновскими лучами или гамма-лучами.
Также существует фотоионизация малых молекул, как то кислород (O2). Фотоионизация происходит в верхних слоях атмосферы, где ультрафиолетовое излучение от Солнца вызывает ионизацию кислорода и азота (N2) в их молекулярных формах.
Вот, что такое ионизация в популярном виде.